Periphere arterielle Verschlusskrankheit (pAVK)
HINTERGRUND
Arteriosklerose (Überbegriff), Atherosklerose (am häufigsten), Mediasklerose, Arteriolosklerose.
Unter dem Hauptbegriff „Atherosklerose“ (ICD-10-Diagnosecode: I70) werden die atherosklerotischen Veränderungen der Aorta, der Nierenarterien sowie der Extremitätenarterien zusammengefasst. Zum (erweiterten) Formenkreis der atherosklerotischen Veränderungen gehören z.B.:
- Koronare Herzkrankheit (KHK)
- Periphere arterielle Verschlusskrankheit (pAVK)
- Karotisstenose
Die periphere arterielle Verschlusskrankheit (pAVK) zählt neben der koronaren Herzkrankheit (KHK), der Karotisstenose und dem abdominellen Aortenaneurysma (AAA) zu den wichtigsten Manifestationen der Atherosklerose. Laut Gesundheitsberichterstattung von 1998 hatten etwa 3.000.000 Bundesbürger die Diagnose pAVK. Im morbiditätsorientierten Risikostrukturausgleich, einer Datenbasis der gesetzlichen Krankenversicherungen in Deutschland, waren 2016 etwa 1.000.000 Versicherte im stationären Versorgungssektor von einer pAVK betroffen. Die Behandlung dieser Gruppe beträgt dabei mehr als 6,5 Mrd. Euro pro Jahr. In größeren Screeningstudien waren etwa 20 % der Männer und 17 % der Frauen betroffen, was in der Altersgruppe zwischen 45 und 74 Jahren auch in der epidemiologischen Hamburg City Health Studie (HCHS) bestätigt wurde. Weltweit wurden 2015 über 230 Mio. betroffene Patienten berechnet.
Bemerkenswert ist außerdem, dass derzeit etwa 463 Mio. Einwohner weltweit von einem Diabetes betroffen sind, wobei die Entwicklung vaskulärer Komplikationen und einer kritischen Extremitätenischämie zu den häufigen Spätfolgen gehört. Unter den symptomatischen pAVK-Patienten/-innen werden im Verlauf der Erkrankung mehr als 25% umgekehrt eine Diabetes-Diagnose entwickeln.
Wesentlicher Risikofaktor für die Entwicklung und das Voranschreiten der Erkrankung ist das Rauchen.
Wichtige Risikofaktoren:
- Rauchen
- Arterielle Hypertonie
- Fettstoff wechselstörung
- Diabetes mellitus
- Adipositas
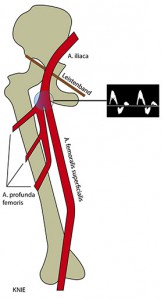
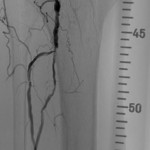
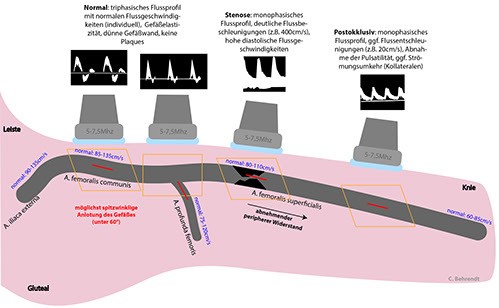
Abbildung: Schematische Darstellung der arteriellen Gefäße der Femoralisgabel. Triphasisches (gesundes) Flussprofil einer elastischen Arterie.
EPIDEMIOLOGIE UND VERSORGUNGSREALITÄT
Großteil der vaskulären Hauptdiagnosen in Deutschland (z.B. ICD-10: I70.2 und I73.9) mit über 180.000 DRG-Hauptdiagnosen im stationären Sektor (Mehrfacherfassungen möglich!). Prävalenz unter Männern in Deutschland etwa 10%, bei Frauen etwa 7%.
Im Jahre 2013 wurden in Deutschland etwa 190.000 Gefäßinterventionen (PTA, Stentangioplastie) und ca. 95.000 offene Eingriffe bei pAVK (Bypass, Thrombendarteriektomien) durchgeführt.
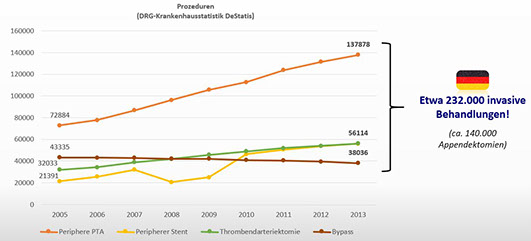
Abbildung: Entwicklung der invasiven Behandlungen der pAVK von 2005 bis 2013. Mittlerweile mehr invasive pAVK-Behandlungen als Appendektomien!
RISIKOFAKTOREN
Zu den typischen Risikofaktoren gehört das Rauchen, die arterielle Hypertonie, eine Dyslipidämie, Diabetes mellitus, Adipositas.
Dementsprechend beinhalten die Empfehlungen zur Prävention und konservativen Therapie der Atherosklerose:
- Strikte Nikotinkarenz
- Gesunde (mediterrane) Diät mit Kochsalzreduktion
- Körperliche Aktivität (optimal: Beobachtetes Gehtraining)
- Gewichtsreduktion
- Optimale Blutdruckeinstellung
- Einstellung der Blutfette (Statine)
- Einstellung einer diabetischen Stoffwechsellage
- Thrombozytenaggregationshemmer (z.B. ASS)
KLINIK
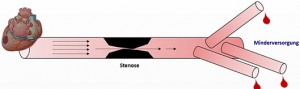
Die periphere arterielle Verschlusskrankheit (pAVK) äußert sich im klinischen Alltag typischerweise durch einen belastungsabhängigen Schmerz in der Gluteal-, Oberschenkel- oder Unterschenkelregion. Bei distalen Läsionen kann auch ein isolierter Schmerz in den Füßen auftreten. Anhand der Schmerzlokalisation lassen sich Rückschlüsse auf die ursächlichen Läsionen ziehen; anhand der Gehstrecke oder anhand des Nachweises von Hautläsionen lässt sich eine Stadieneinteilung (Fontaine, Rutherford) vornehmen.
Die ursächlichen Gefäßverengungen finden sich typischerweise im Bereich der aorto-iliakalen Strombahn (Prädilektionsstelle: Iliakalbifurkation), im Bereich der Femoralisgabel, im Verlauf der A. femoralis superficialis, in der Poplitealstrombahn oder im Bereich der drei Unterschenkelgefäße (z.B. bei der diabetischen AVK). Ein Verschluss der AFS führt typischerweise zu einer belastungsabhängigen Wadenclaudicatio!

Abbildung: Etageneinteilung der pAVK. Häufig ist der Oberschenkeltyp mit Stenosierungen der AFS und Wadenclaudicatio!
Anamnestisch hinweisende Fragen (nach dem San Diego Claudication Questionnaire):
- Haben Sie Schmerzen oder Beschwerden in den Beinen beim Laufen?
- Bestehen die Schmerzen jemals in Ruhe beim Stehen oder Sitzen?
- Besteht dieser Schmerz in den Waden?
- Treten die Schmerzen bei normaler Gehgeschwindigkeit auf?
- Wie weit können Sie laufen, bevor die Beschwerden beginnen?
- Was tun Sie, wenn die Beschwerden auftreten?
- Was passiert beim Stehenbleiben?
In Deutschland gebräuchliche klinische Einteilung nach Fontaine:
- pAVK im Stadium I:
Keine Gehstreckenminderung bei Nachweis einer pAVK - pAVK im Stadium IIA:
Nur geringe Gehstreckenminderung zwischen 200-1000m - pAVK im Stadium IIB:
Relevante Gehstreckenminderung unter 200m - pAVK im Stadium III:
Schmerzen in Ruhe (CAVE: Kritische Extremitätenischämie!) - pAVK im Stadium IV:
Ulcera oder Nekrosen (CAVE: Kritische Extremitätenischämie!)
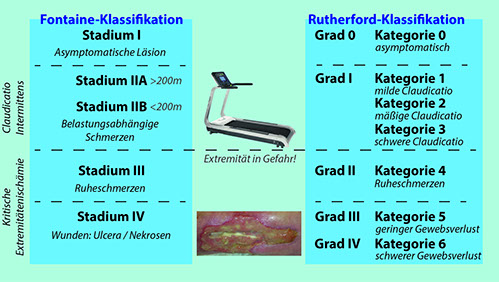
Abbildung: Klassifikationen der pAVK (links Fontaine, rechts Rutherford). Wichtig: Bei Ruheschmerzen beginnt die kritische Extremitätenischämie!
DIAGNOSTIK
Pulsstatus
Wesentlich bei der klinischen Untersuchung von pAVK-Patienten ist die Erhebung eines guten Pulsstatus. Von besonderer klinischer Relevanz sind die Pulse der A. femoralis (communis) im Bereich des Leistenbandes, die Pulse der A. poplitea in der Kniekehle sowie die distalen Fußpulse der A. tibialis posterior (Innenknöchel) und der A. dorsalis pedis (Fußrücken). Bei der Erhebung des Pulsstatus ist stets auf einen Seitenvergleich und die Pulsqualität zu achten. Bei kräftigen seitengleichen peripheren Pulsen ist eine hochgradige pAVK sehr unwahrscheinlich.

Abbildung: Palpationspunkte des Pulsstatus. Bei seitengleichen kräftigen Fußpulsen ist eine schwere pAVK unwahrscheinlich.
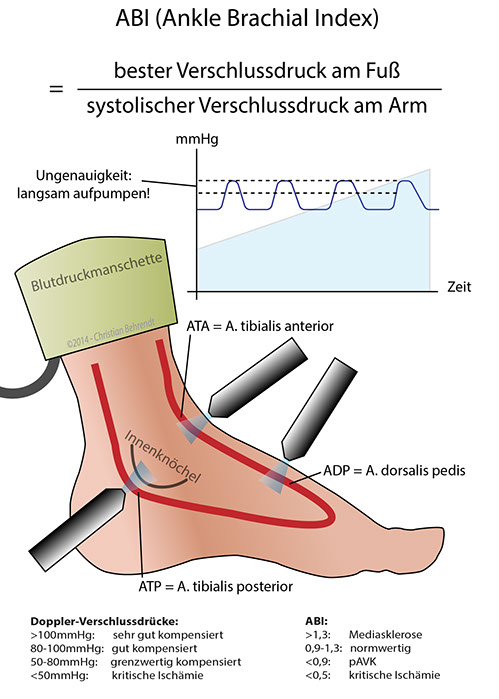
Ankle-Brachial-Index (Knöchel-Arm-Index), Dopplerverschlussdruckmessung
Zu den nichtinvasiven diagnostischen Methoden mit hohem Stellenwert gehört der Ankle-Brachial-Index. Hierbei wird mit einem kleinen Dopplergerät die Blutströmung in den begutachteten Gefäßen (ATA/ADP, ATP) durch ein Geräusch nachgewiesen. Hochwertige Geräte erlauben dabei auch eine Beurteilung des Flussprofils. Eine Blutdruckmanschette wird möglichst nah am Messpunkt (kurz oberhalb des Knöchels) langsam aufgepumpt, bis kein Blutstrom mehr im Gefäß nachweisbar ist. Der in diesem Augenblick gemessene Druck in mmHg entspricht dem Verschlussdruck des Gefäßes. Die Einzelverschlussdrücke der insgesamt vier Gefäße (links und rechts) werden durch den gemessenen systolischen Blutdruck am Arm (A. brachialis) geteilt und anhand dessen der ABI berechnet.
- ABI > 1,2: Verdacht auf mediasklerotische Veränderungen (z.B. Diabetes mellitus)
- ABI zwischen 0,9 – 1,2: normwertig
- ABI < 0,9: Verdacht auf pAVK
- ABI < 0,5: Verdacht auf kritische Ischämie
Für die Berechnung des ABI existieren mehrere Methoden, die kontrovers diskutiert werden. Grundsätzlich stellt sich immer wieder die Frage, ob der höhere oder niedrigere Verschlussdruck der Unterschenkelgefäße verwendet werden soll. Einige Autoren verwenden auch einen Mittelwert aus beiden Einzelwerten. In einem Statement der American Heart Association (AHA) zur Messung und Interpretation des ABI, das 2012 in der Circulation veröffentlicht wurde, kamen die Autoren zu dem Schluss, dass der ABI jedes Beins durch Division des HÖHEREN Verschlussdruckes durch den HÖHEREN Armdruck berechnet werden sollte.
Recommendations for the Calculation of the ABI
The ABI of each leg should be calculated by dividing the higher of the PT or DP pressure by the higher of the right or left arm SBP (Class I; Level of Evidence A)
In der aktuellsten deutschsprachigen Leitlinie zur pAVK (11/2015) wird, hiervon abweichend, wieder der niedrigste Verschlussdruck als Berechnungsgrundlage empfohlen, was durch zwei Literaturstellen aus 2006 und 2008 untermauert wird.
Oszillographie
Bei der Oszillographie werden verschiedene Techniken angewendet. Gängig ist z.B. die Nutzung von Blutdruckmanschetten und piezoelektrischen Messsonden, die eine Pulsatilität im Gewebe nachweisen können. Man unterscheidet eine segmentale Oszillographie (Oberschenkelniveau, Knieniveau und Knöchelniveau) von der akralen Oszillographie an den Fußzehen. Anhand der gemessenen Kurvenpulsatilität (normwertig: steiler Anstieg, schmaler Gipfel, etwas verzögerter Abfall, keine Nulllinien) lassen sich Rückschlüsse auf die Gefäßversorgung und ggf. kollateralisierte Verschlüsse ziehen. Die Oszillographie hat insbesondere einen hohen Stellenwert bei Patienten mit einem diabetischen Fußsyndrom, wo die Dopplerverschlussdruckmessung nur einen eingeschränkten Stellenwert besitzt.
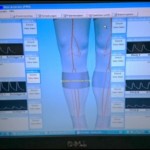
Abbildung: Beispiel für eine segmentale Oszillographie. Insbesondere ab dem Knöchelniveau (unteres Oszillogramm) auf beiden Seiten deutlich eingeschränkte Amplitude.
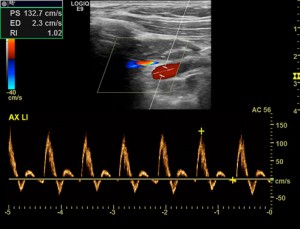
Farbkodierte Duplexsonographie
Die Duplexsonografie (auch Doppler-Sonografie) nutzt den im 19. Jahrhundert durch C. A. Doppler erstmals beschriebenen physikalischen Effekt, dass sich Frequenzen bzw. Wellenlängen durch Abstandsvariationen scheinbar verändern. Bis auf eine geringe frequenzabhängige Erwärmung des Gewebes durch die eingebrachten Ultraschallwellen gibt es bis heute keinen Nachweis für ein schädigendes Potenzial des Verfahrens. Man unterscheidet bei der Sonographie grundsätzlich das sogenannte B-Bild (Grauwertbild) vom Dopplerbild (CW-Continuous-wave, PW-Pulsed-wave). Flussgeschwindigkeiten werden im Dopplerbild gemessen. In der Duplexsonographie lassen sich in der gesamten aorto-iliakalen und peripheren arteriellen Strombahn Stenosen durch Flussbeschleunigungen oder Unterbrechungen darstellen.
MR-Angiographie
Bei der MR-Angiographie werden starke Magnetfelder oder Radiowellen genutzt, um aus den daraus resultierenden Kernresonanzen verschiedener Elemente ein Bild zu errechnen. Als extrazelluläre Kontrastmittel werden in der Regel paramagnetische gadoliniumhaltige Substanzen (HWZ ca. 90 Minuten) verwendet. Gadolinium führt zu einer Signalzunahme in der T1-Wichtung. Die Stärke der verwendeten Magnetfelder wird mit der Einheit Tesla (T) angegeben. Moderne Geräte arbeiten im Bereich bis 1,5 Tesla. Seit den 1980er Jahren gewinnt die MRT immer größere Bedeutung in der Medizin.
Vorteile der MR-Angiographie:
- keine Strahlenbelastung, keine jodhaltigen Kontrastmittel erforderlich (Allergien, Hyperthyreose)
- übersichtliche Darstellung
Nachteile der MR-Angiographie:
- (im Vergleich zur DSA) schlechte räumliche Auflösung
- Überschätzung des Stenosegrades
- Signalauslöschung durch Stents und Fremdkörper
- Gefahr der Nephrogenen Systemischen Fibrose (v.a. bei Niereninsuffizienz!)
- Kontraindikationen: Nicht-MR-fähige Schrittmacher, Implantate, Klaustrophopie, unruhige Patienten, schweres Übergewicht, KM-Allergie
Mögliche Nebenwirkungen von MR-Kontrastmittel sind Übelkeit und Erbrechen, Wärmegefühl, Kopfschmerzen, Parästhesien, Schwindel, Krämpfe und weitere. Abhängig vom Verlauf werden Frühreaktionen (erste 60 Minuten) von Spätreaktionen (bis zu 3 Tage) unterschieden.

Abbildung: MR-Angiographie einer infrarenalen Aortenstenose. Der Patient beklagt Glutealclaudicatio und Oberschenkelschmerzen bei kurzen Gehstrecken.
CT-Angiographie
Aufgrund der hohen Auflösung moderner Spiral-Computertomographen sind immer bessere Bilder mit geringerer Strahlenbelastung möglich. Die beiden Erfinder A. M. Cormack und G. N. Hounsfield („Hounsfield Einheit“) wurden 1979 mit dem Nobelpreis für Medizin gewürdigt. Insbesondere zur Therapieplanung vor Bypassanlage findet die CT-Angiographie heute Anwendung. Als Kontrastmittel werden in der Regel wasserlösliche jodhaltige Substanzen verwendet. Die moderneren jodhaltigen nichtionischen Substanzen sind mittlerweile gut verträglich und werden über die Niere, über den Darm und das hepatobiliäre System eliminiert.
Vorteile der CT-Angiographie:
- hohe Auflösung, schnelle Durchführung
- Kalk gut darstellbar
- flächendeckend verfügbar
Nachteile der CT-Angiographie:
- Strahlenexposition (mSv)
- Kontrastmittelallergien (selten)
- Gefahr der kontrastmittelassoziierten Nephropathie (v.a. bei Niereninsuffizienten)
- Gefahr der jodinduzierten Hyperthyreose
- Artefakte bei Fremdkörpern oder schwerer Verkalkung
- gelegentlich unzuverlässige Beurteilung des Stenosegrades
Von besonderer Bedeutung vor einer Kontrastmittelgabe ist die Anamnese möglicher Kontrastmittel- oder Jodallergien (prophylaktische Therapie mit H1-, H2-Blockern und Glukokortikoiden), die Anamnese von hyperthyreoten Stoffwechsellagen (thyreostatische Therapie) und die Evaluation der Nierenfunktion (ggf. Vor- und Nachbewässerung mit NaCl).
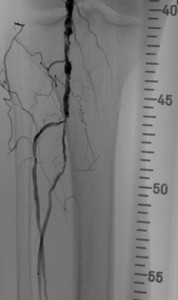
Digitale Subtraktionsangiographie
Bei der sogenannten digitalen Subtraktionsangiographie (DSA) wird das Zugangsgefäß (in der Regel A. femoralis communis) mithilfe der Seldinger-Technik (siehe weiter unten) punktiert und ein Angiographiekatheter in das Zielgefäß eingebracht. Unter Röntgendurchleuchtung (C-Bogen, Bildwandler) wird jodhaltiges Kontrastmittel (alternativ ggf. CO2-Kontrastmittel) injiziert und das Gefäß dargestellt. Die Recheneinheit der Röntgenanlage subtrahiert anschließend während der Durchleuchtungszeit unveränderte Bestandteile (z.B. Knochen) und verstärkt die Kontrastmitteldarstellung. Die ideale Angiographie stellt somit nur das intravasale Kontrastmittel dar, während der Hintergrund hellgrau erscheint.
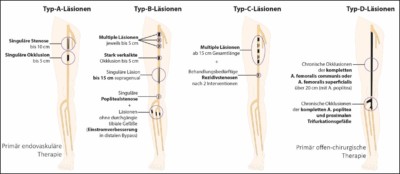
Abbildung: Schematische Darstellung der Klassifikation infrainguinaler Läsionen (unterhalb des Leistenbandes) nach der TASC-II Klassifikation. Typ-A-Läsionen werden primär endovaskulär, Typ-D-Läsionen eher offen-chirurgisch behandelt.
Seldinger-Technik
Die bereits in den 1950er Jahren von Sven-Ivar Seldinger beschriebene Technik zur Punktion von Gefäßen und Einbringen von Kathetern findet Anwendung in vielen Bereichen (z.B. ZVK-Anlage, Koronarangiographien, periphere Interventionen, endovaskuläre Aortenversorgung).
Das Prinzip ist dabei stets gleich:
- Lokalanästhesie (falls nötig)
- Perkutane Punktion mit der Punktionsnadel
- Entfernen des Mandrins, pulsierender Austritt von Blut
- Vorschieben des dünnen Führungsdrahtes durch die Hohlnadel
- Herausziehen der Hohlnadel über den Führungsdraht (diesen fixieren!)
- Einführen der Schleuse (ggf. nach Vordilatation) über den Führungsdraht
- Entfernung des Führungsdrahtes, Aspiration und Spülung (NaCl/Heparin)
THERAPIE
Für die Therapie der pAVK stehen neben den konservativen Verfahren (z.B. Risikooptimierung, gerinnungswirksame Medikation, Gehtraining, Rheologika) vor allem endovaskuläre und offen-chirurgische Verfahren zur Verfügung. Die Wahl der Therapie sollte sich nach der Lokalisation, dem Stadium und weiteren Begleitumständen orientieren. In der Regel werden endovaskuläre Revaskularisationen ab einem Stadium IIB nach Fontaine mit entsprechendem Leidensdruck des Patienten durchgeführt. Bis auf wenige Ausnahmen bleiben offen-chirurgische Verfahren (z.B. Bypasschirurgie, Thrombendarteriektomie) eher den kritischen Extremitätenischämien (Stadium III oder IV nach Fontaine) vorbehalten.
Konservative Therapie:
- Risikofaktoren optimieren (generell: Nikotinkarenz, optimale Blutdruckeinstellung, Thrombozytenaggregationshemmung mit ASS 100mg 1x täglich, Lipid-Modifizierung und Statintherapie, Körpergewichtsoptimierung, Ernährungsumstellung, Optimierung der kardiovaskulären Grunderkrankungen und Risikofaktoren, Behandlung eines Diabetes)
- Konsequentes begleitetes Gehtraining („In den Schmerz hineinlaufen“, Kollateralisierung fördern, Therapieerfolg dauert Monate bis Jahre)
- Prophylaktische Medikamentöse Therapie der pAVK: Thrombozytenaggregationshemmer (z.B. ASS, Clopidogrel), Lipidsenker (z.B. Atorvastatin), ggf. ACE-Hemmer
- Vasoaktive Substanzen (z.B. Cilostazol) bei pAVK IIB mit deutlich eingeschränkter Lebensqualität ohne adäquates Gehtraining und ohne Revaskularisationsmöglichkeit
- Rheologische Therapie mit PGE-1 (z.B. Alprostadil, Iloprost) bei kritischer Extremitätenischämie langsam i.v. über mehrere Tage (14-28 Tage)
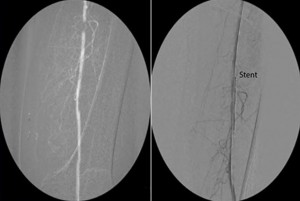
Endovaskuläre Therapie:
- Antegrade oder retrograde Punktion (z.B. A. femoralis communis, Unterschenkelarterien) nach der Seldinger-Technik
- Digitale Subtraktionsangiographie in Interventionsbereitschaft
- Ballonangioplastie, Stentangioplastie und weitere Verfahren (z.B. Atherektomie, Cutting-Ballon)
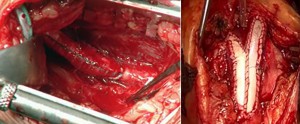
Offen-chirurgische Therapie:
- Lokale Desobliteration (Thrombendarteriektomie: Ausschälplastik)
- Bypasschirurgie (z.B. femoro-poplitealer Bypass, femoro-cruraler Bypass auf die A. tibialis anterior)
- Hybridverfahren (offen-chirurgische und endovaskuläre Verfahren kombiniert)