Einen wichtigen Stellenwert in der vaskulären Stufendiagnostik haben schnittbildgebende Verfahren, bei denen Kontrastmittel (z.B. jodhaltig, gadoliniumhaltig) verwendet werden.
Spiralcomputertomographie
Bei der sogenannten kontrastmittelgestützten Spiral-CT-Angiographie (SCTA) wird jodhaltiges Kontrastmittel über die peripheren Venen injiziert und nach einer kurzen Passagezeit dargestellt. Den beiden Erfindern dieser röntgendiagnostischen Bildgebung, A. M. Cormack und G. N. Hounsfield („Hounsfield-Einheiten“), wurde 1979 der Nobelpreis für Medizin verliehen.
Anwendung findet die SCTA in nahezu allen anatomischen Regionen der vaskulären Diagnostik (supraaortale Gefäße, thorako-abdominelle Aorta, viszerale Gefäße, periphere Gefäße). Durch die hohe Auflösung und die Möglichkeiten der 3D-Rekonstruktionen ist die SCTA weiterhin Goldstandard in der Therapieplanung interventioneller Verfahren an der Aorta. Moderne Geräte verfügen über eine sehr gute Bildqualität trotz geringerer Aufnahmezeiten. Die kalkulierte Strahlendosis einer modernen SCTA in 3 Phasen (nativ, arteriell, venös) beträgt heute noch etwa 30 mSv (Vergleich: Röntgenabdomenaufnahme etwa 2 mSv).

Abbildung: Ausgeprägte Lungenarterienembolie (gelb markiert) nach tiefer Venenthrombose. Die Patientin beklagte nur geringgradige Belastungsdyspnoe und Husten (bei Infarktpneumonie)
Die CT-Angiographie ist das Verfahren der Wahl bei Aortendissektionen, Aortenaneurysma, Lungenarterienembolie und weiteren Krankheitsbildern.
- Sensitivität (abhängig von Fragestellung): (z.B. Verlaufskontrolle nach EVAR): 90 – 100 %
- Spezifität (abhängig von Fragestellung): bis 96 %
- Vorteile: sehr hohe Auflösung, gute Verfügbarkeit, kurze Untersuchungszeit, 3D-Rekonstruktionen
- Nachteile und Gefahren: Strahlenexposition (Röntgen), Kontrastmittelallergien, kontrastmittelassoziierte Nephropathie, jodinduzierte Hyperthyreose, Antidiabetika (Laktatazidose!)
Kontrastmittelassoziierte Nephropathie:
Kontrastmittelassoziierte Nephropathie: Nach Kontrastmittelgabe tritt dosisabhängig bei etwa 1 % der vorher Nierengesunden und bei bis zu 50 % der vorerkrankten Patienten eine, zumindest vorübergehende, kontrastmittelassoziierte Nephropathie auf. Diese ist definiert durch den Anstieg des Serumkreatininwerts um mindestens 25 % (oder mehr als 0,5 mg/dl) innerhalb von 48 – 72 h nach Kontrastmittelgabe ohne andere Erklärung. Die generelle Inzidenz der kontrastmittelassoziierten Nephropathie liegt einer aktuellen Metaanalyse zufolge bei ca. 5 %. Risikofaktoren für ihr Auftreten sind ein Lebensalter über 65 Jahren, eine glomeruläre Filtrationsrate unter 45 ml/min und ein Diabetes mellitus
Niereninsuffizienz
Niereninsuffizienz:Wesentlich seltener ist das Auftreten einer dialysepflichtigen Niereninsuffizienz. Bei vorerkrankten Risikopatienten mit einem Serumkreatininwert über 1,4 mg/dl (glomeruläre Filtrationsrate unter 60 ml/min) liegt das Risiko dafür bei etwa 0,8 %. Als nephroprotektiv gilt eine Vor- und Nachbewässerung mit 0,9 %iger NaCl-Lösung (Kochsalzlösung; 10 ml/kg Körpergewicht) über 24 h periprozedural sowie die möglichst orale Gabe von 2×600 mg Acetylcystein am Vortag, dessen protektiver Effekt mehrfach kontrovers diskutiert, aber noch nicht abschließend verstanden wurde.
Anaphylaktische Reaktion (KM-Allergie)
Anaphylaktische Reaktion: Zur Vermeidung einer anaphylaktischen Reaktion auf Kontrastmittel kann bei Vorliegen einer gesicherten Kontrastmittelallergie die vorbereitende intravenöse Gabe eines H1-Antihistaminikums (z. B. Clemastin), eines H2-Antihistaminikums (z. B. Ranitidin) und von Prednisolon über 3 Tage sowie die Stoßtherapie mit Prednisolon am Tag der Kontrastmittelgabe evaluiert werden.
Hyperthyreose
Letztlich kann das Kontrastmittel auch zu einer potenziell lebensbedrohlichen jodinduzierten
Hyperthyreose führen; deshalb wird bei Risikopatienten eine medikamentöse thyreostatische
Therapie mit 900 mg Natriumperchlorat pro Tag sowie gegebenenfalls mit 10–20 mg Thiamazol pro Tag vor der Kontrastmittelgabe über 10 – 14 Tage unter Verlaufskontrolle der Schilddrüsenparameter empfohlen.
Magnetresonanztomographie
Synonyme: MRT, MR, Kernspintomographie, MRI (engl.)
Bei der magnetresonanztomographischen Angiographie (MRA) werden starke Magnetfelder oder Radiowellen eingesetzt, um aus den daraus resultierenden Kernresonanzen verschiedener Elemente ein Bild zu errechnen.
Die MRA hat z.B. in der Bildgebung der extrakraniellen hirnversorgenden Gefäße einen wichtigen Stellenwert, findet aber auch häufig bei Untersuchungen zur pAVK Anwendung. Aufgrund der etwas eingeschränkten Auflösung und der fehlenden Beurteilbarkeit von Verkalkungen konnte die MRA die CT-Angiographie bei der Therapieplanung vor der Versorgung abdomineller Aneurysmen bisher noch nicht ablösen.
Bei absoluten Kontraindikationen gegen gängige MR-Kontrastmittel kann in ausgewählten Fällen auch eine kontrastmittelfreie Angiographie (sog. TOF-MRA, „Time-of-flight-MRA“) versucht werden, wobei diese Untersuchung recht artefaktanfällig ist.
- Sensitivität (abhängig von Fragestellung): 96 % (z.B. bei Verlaufskontrolle nach EVAR)
- Spezifität (abhängig von Fragestellung): bis 100 %
- Vorteile: keine Strahlenbelastung (Magnetwellen), kein jodhaltiges Kontrastmittel (i.d.R. Gadolinium)
- Nachteile und Gefahren: eingeschränkte Auflösung, hohe Kosten und geringe Verfügbarkeit, Verkalkungen der Gefäßwand nicht suffizient beurteilbar (Stenosen werden eher überschätzt), längere Untersuchungsdauer, Kontrastmittelallergien, Nephrogene systemische Fibrose (NSF), Geräuschbelastung
Grenzen der MRA
- Störanfällige Implantate: Ferromagnetische oder elektromagnetisch störanfällige Implantate im Körper des Patienten (z. B. implantierbare Kardioverter-Defibrillatoren, Cochlea-Implantat) stellen Kontraindikationen für eine MRA-Untersuchung dar
- Allergien gegen gadoliniumhaltige Kontrastmittel
- Vorliegen einer relevanten Niereninsuffizienz: Bei vorbestehend schwerer Einschränkung der Nierenfunktion kann es nach Gadoliniumgabe sehr selten zu
einer potenziell tödlichen nephrogenen systemischen Fibrose kommen, die sich durch krankhafte Bindegewebevermehrung in der Haut und den inneren Organen äußert - Klaustrophobie: Aufgrund der Bauform und der starken Geräuschkulisse vieler MRA-Geräte ist diese Diagnostik außerdem bei Patienten mit Klaustrophobie nicht ohneWeiteres anzuwenden. Modernere Geräte mit einer offenen oder sogar stehenden Bauform (sog. Upright-Geräte) können in diesen Fällen eine Alternative darstellen
Digitale Subtraktionsangiographie
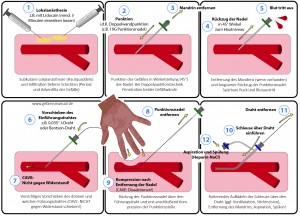
Bei der digitalen Subtraktionsangiographie (DSA) handelt es sich um ein invasives röntgendiagnostisches Verfahren zur Darstellung arterieller (intraarterielle DSA) oder venöser (intravenöse DSA) Gefäße. Unter sterilen Kautelen wird ein Zugangsgefäß (i.d.R. A. femoralis communis) mithilfe der Seldinger-Technik punktiert und über entsprechende Katheter Kontrastmittel in die Zielregion eingebracht. Während der Applikation des Kontrastmittels (z.B. jodhaltiges KM oder CO2) werden mehrere Röntgenbilder mit einem Bildwandler gemacht und durch eine Recheneinheit nachbearbeitet. Gleichbleibende Strukturen (z.B. Knochen, Darmgasüberlagerungen) werden digital abgeschwächt, während das einfließende Kontrastmittel verstärkt wird. Das ideale DSA-Bild stellt somit nur die kontrastmitteldurchströmten Gefäße in einer guten Übersichtlichkeit und hohen Auflösung dar.
Einen hohen Stellenwert hat die DSA vor allem in der Diagnostik und (gleichzeitigen) Therapie der peripheren arteriellen Verschlusskrankheit, da über die einliegenden Schleusen auch Behandlungsdevices (z.B. Ballons oder Stents) eingebracht werden können, um die dargestellten Stenosierungen zu behandeln. Bei der endovaskulären Versorgung des Aortenaneurysmas bzw. der Aortendissektion erfolgt die Platzierung der Stentprothesen nach dem gleichen Prinzip.
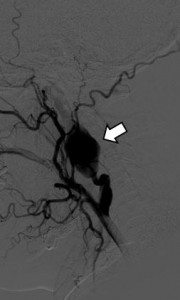
Abbildung: DSA eines großen Aneurysmas der A. carotis interna (Pfeil) vor offen-chirurgischer Aneurysmaausschaltung (Interponat)
Nachteile und Gefahren der DSA: Aufgrund der Kontrastmittelapplikation und der Strahlenexposition gleicht dieses Verfahren der SCTA. Im Zusammenhang mit der invasiven Punktion der Zugangsgefäße besteht darüber hinaus die Gefahr von lokalen Blutungen, Dissektionen, Aneurysmata, Embolien oder Fisteln.