Abdominelles Aortenaneurysma (AAA)
HINTERGRUND
Als Aneurysma (altgriechisch: ανεύρυσμα= Erweiterung) wird die krankhafte Erweiterung einer Arterie bezeichnet. Bei der abdominellen Aorta ist dies ab einem Querdurchmesser von 3 cm der Fall. Geringe Erweiterungen zwischen 2,5 und 3 cm werden dagegen als Aortenektasie bezeichnet. Der normale Durchmesser der gesunden Bauchaorta beträgt etwa 1,7 bis 2 cm und hängt unter anderem von der Körpergröße sowie vom Geschlecht ab. Eine besondere Gefahr besteht in der Ruptur von größeren Aortenaneurysmen, welche mit einer hohen Letalität verbunden ist. Ab einem Querdurchmesser von 5 bis 5,5 cm ist daher die invasive Therapie angezeigt, da das Rupturrisiko im Spontanverlauf größer ist, als das Risiko der operativen Versorgung. Für die Behandlung des Aortenaneurysmas stehen konservativ-medikamentöse, offen-chirurgische und endovaskuläre Therapiekonzepte zur Verfügung, die sich teilweise ergänzen. Während die endovaskulären Verfahren ursprünglich für Patienten entwickelt wurden, für die eine offen-chirurgische Behandlung aufgrund des hohen OP-Risikos nicht zur Verfügung stand, hat sich die Aneurysma-Therapie international dahingehend gewandelt, dass heute bereits bis zu 74 % aller Bauchaortenaneurysmen endovaskulär versorgt werden.
ANATOMIE DER AORTA
Die Aorta entspringt dem linken Herzen auf Höhe des 3. Interkostalraums und geht über die Aorta ascendens in den Aortenbogen über. Aus dem Aortenbogen entspringt im Normalfall der Truncus brachiocephalicus, die linke A. carotis communis sowie die linke A. subclavia. Der nachfolgende Abschnitt der Aorta, die Aorta descendens, verläuft gemeinsam mit dem Ductus thoracicus durch den Hiatus aortae retroperitoneal in den abdominalen Abschnitt. Im Verlauf gehen mehrere paarig angelegte Segmentarterien als Interkostalarterien (Brustkorb) oder als Lumbalarterien (Abdomen) von der Aorta ab. Diese paarigen Arterien spielen eine besondere Rolle für die Kollateralversorgung des Rückenmarks (besondere Bedeutung: A. radicularis magna = Adamkiewicz Arterie). Auf Höhe des 12. Brustwirbels entspringt der Truncus coeliacus und wenig später die A. mesenterica superior (AMS), welche über die Bühlersche Anastomose miteinander verbunden sind. Kurz vor der Aortenbifurkation auf Höhe des 4. Lendenwirbelkörpers entspringt die A. mesenterica inferior (AMI), welche unter anderem über die Riolansche Anastomose mit der AMS verbunden ist. Zahlreiche weitere Gefäßanastomosen und die vorgenannten Segment- und Lumbalarterien sichern die spinale Durchblutung und die Versorgung der viszeralen Organe (Abbildung 1).

Abbildung: Darstellung der Abgänge der thorakalen und abdominellen Aorta. Von besonderer Bedeutung sind die segmental paarig abgehenden Arterien zur Versorgung des Rückenmarkes (Gefahr der spinalen Ischämie: Querschnittssyndrom).
Die abdominelle Aorta ist eine Arterie vom elastischen Typ und weist eine typische Dreischichtung auf (Abbildung 2):
- Tunica intima: Endothel, einschichtiger Zellverband
- Tunica media: glatte Muskelzellen, elastische Fasern, mehrschichtiger Zellverband
- Tunica externa / Adventitia: Kollagenfasern, elastische Fasern
Die Tunica media ist mit ihren zahlreichen glatten Muskelzellen maßgeblich für die Tonusregulation verantwortlich, während die Adventitia wichtige Versorgungsfunktionen übernimmt.
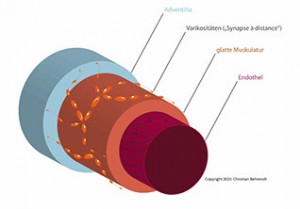
Abbildung: Typischer Aufbau der Widerstandsgefäße. Die Innervation erfolgt in der Regel durch sogenannte Varikositäten (Auftreibungen der Nervenfasern, „Synapse a distance“).
KLASSIFIKATION DES BAUCHAORTENANEURYSMAS
Traditionell werden Aneurysmen in drei unterschiedliche Arten unterteilt:
- Aneurysma verum (echtes Aneurysma): Das echte Aneurysma bezieht alle 3 Wandschichten mit ein und weist einen um mindestens 50 % gegenüber dem gesunden Gefäßabschnitt erweiterten Durchmesser auf.
- Aneurysma spurium (falsches Aneurysma, Pseudoaneurysma): Bei dem falschen Aneurysma ist eigentlich nicht das Gefäß an sich erweitert, sondern durch einen Gefäßdefekt (z.B. Punktionsstelle) tritt Blut aus dem Gefäß in das umliegende Gewebe aus. Es entsteht ein perivaskuläres Hämatom mit Kapsel, welches pulsiert.
- Aneurysma dissecans (Dissektion): Bei der Dissektion kommt es zu einer „Wühlblutung“ in der Media des Gefäßes. Vorangehend hat in der Regel ein Einriss der Intima zu einem sogenannten „Entry“ geführt. Es bildet sich eine flottierende Dissektionslamelle im Gefäßlumen. Bei der Dissektion wird ein wahres Lumen von einem falschen Lumen unterschieden. Die Dissektion beschreibt an sich keine Aneurysmatische Erweiterung, kann jedoch eine wichtige Ursache hierfür sein.
Das echte Bauchaortenaneurysma (Aneurysma verum) kann anhand verschiedener Klassifikationen unterteilt werden. Besondere Bedeutung hat die Einteilung anhand der Lokalisation und Einbeziehung der Nierenarterien (Abbildung 3):
- Typ-IV-Aortenaneurysma (nach der Crawford-Klassifikation): Aneurysma des thorako-abdominellen Abschnitts; überschreitet die Zwerchfellgrenze
- Suprarenales Aortenaneurysma: Aneurysma befindet sich streng oberhalb der Nierenarterien
- Juxtarenales Aortenaneurysma: Aneurysma bezieht die Nierenarterienabgänge mit ein
- Infrarenales Aortenaneurysma: Aneurysma befindet sich streng unterhalb der Nierenarterienabgänge

Abbildung: Schematische Darstellung verschiedener Klassifikationen der Dissektionen (z.B. Stanford, Debakey) und Aortenaneurysmen (z.B. suprarenal, juxtarenal, infrarenal).
Anhand der Ätiologie kann das AAA in 5 verschiedene Entitäten eingeteilt werden. Das atherosklerotische AAA ist mit Abstand am häufigsten. Es folgen das traumatische, das inflammatorische, das mykotische und das poststenotische AAA. Morphologisch werden außerdem die fusiformen (spindelförmige Aussackung der gesamten Zirkumferenz) von den sakkulären (lokalisierte sackförmige Ausstülpung in eine Richtung) AAA unterschieden.
Früher wurde das AAA außerdem anhand der Allenberg-Klassifikation in 5 Typen unterteilt (Abbildung 4). Anhand dieser Einteilung konnte das optimale Therapieverfahren abgeleitet werden. Aufgrund der großen Fortschritte der endovaskulären Therapie hat diese Klassifikation jedoch nur noch eine eingeschränkte Bedeutung.
PATHOPHYSIOLOGIE DES AORTENANEURYSMAS
Obwohl viele Fragen heute noch nicht abschließend geklärt sind, hat sich in der gefäßmedizinischen Grundlagenforschung ein Konzept der multifaktoriellen Aneurysmaentstehung (Abbildung 5) durchgesetzt. Wesentlich für die Entstehung des Aortenaneurysmas scheinen anhaltende Entzündungsprozesse und eine Proteolyse integraler Bestandteile der Aortenwand. Hinzu kommen unphysiologische Scherkräfte und ein turbulenter Blutfluss durch die lokale Erweiterung der Aorta. Am Ende dieser Prozesse steht eine Abnahme der Wanddicke und damit der Wandintegrität, die letztlich zu einem weiteren Progress mit Rupturgefahr führt.
EPIDEMIOLOGIE UND VERSORGUNGSREALITÄT DES BAUCHAORTENANEURYSMAS
Mit ca. 60 % der registrierten Fälle ist der abdominale Abschnitt die häufigste Lokalisation aller Aortenaneurysmen. Das Bauchaortenaneurysma hat in Registerstudien eine Prävalenz von 4 bis 8 % bei den über 65-jährigen Männern und 0,5 bis 1,5 % bei den gleichaltrigen Frauen. Dabei hängt die Prävalenz maßgeblich von der Größe, dem Patientengeschlecht sowie von verschiedenen Risikofaktoren (z.B. Rauchen) ab. Männer sind mit 6:1 deutlich häufiger betroffen, als Frauen. Die vorgenannten Werte beziehen sich auf das intakte (= nicht rupturierte) AAA. Die Ruptur ist dagegen wesentlich seltener und mit einer deutlich höheren Gesamtletalität verbunden. Etwa 1/3 der Patienten verstirbt bereits auf dem Weg in das Krankenhaus und die Krankenhausletalität beträgt auch bei rechtzeitiger Versorgung, je nach Therapieverfahren und Alter, noch bis zu 60 % (Karthikesalingam et al. 2014, Behrendt et al. 2016). Bei ca. 5 % aller Bauchaortenaneurysmen sind die Nierenarterienabgänge mit einbezogen und bei ca. 20 % der Patienten sind auch die Iliakalgefäße aneurysmatisch erweitert. Eine weitere deutliche Assoziation besteht zum Aneurysma der A. poplitea (Kniekehle). Aufgrund des bereits genannten Trends zu endovaskulären Verfahren verzeichnet das deutsche Register für Bauchaortenaneurysmen mittlerweile einen Anteil von 73 %. Das statistische Bundesamt hat für 2012 insgesamt ca. 8.700 endovaskuläre und 6.060 offen-chirurgische Behandlungen der abdominellen Aorta verzeichnet, wobei diese Statistik vor allem auf Abrechnungsdaten der Kostenträger zurückgreift und daher nur einen Näherungswert liefern kann.
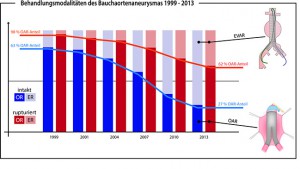
Abbildung: Entwicklung der Behandlungsverfahren (offen chirurgisch vs. endovaskulär) beim intakten und rupturierten abdominellen Aortenaneurysme von 1999 bis 2013: Mittlerweile werden über 70 % aller intakten Befunde endovaskulär behandelt. Bei der Ruptur beträgt der endovaskuläre Anteil über 30 %.
PATHOPHYSIOLOGIE
Das AAA ist eine multifaktoriell bedingte Erkrankung mit zahlreichen, teilweise kontrovers diskutierten, Entstehungsmechanismen:
- Inflammation und Leukozyteninfiltration in die Aortenwand
- Atherosklerose
- Infektion (z.B. durch Chlamydia pneumoniae)
- Oxidativer Stress
- Biomechanische Scherkräfte
- Proteolyse und Verlust an Kollagenen und Elastin in der Aortenwand
- Aktivierung von Matrixmetalloproteinasen (z.B. MMP-2)
- Turbulenter Blutfluss
- Wandthrombosierung
RISIKOFAKTOREN
Eine Vielzahl an Studien hat sich mit den identifizierbaren Risikofaktoren für die Entstehung und den Progress des AAA beschäftigt. Mit großem Abstand am bedeutendsten ist unumstritten das Rauchen. Eine Risikoanalyse an über 126.000 US-Veteranen konnte darüber hinaus noch zahlreiche weitere Risikofaktoren identifizieren (Abbildung 6): Rauchen, Familienanamnese, Lebensalter, Atherosklerose, koronare Herzkrankheit, Hyperlipidämie, COPD.
- Rauchen
- Familiäre Häufung
- Lebensalter
- Atherosklerose
- KHK
- Hyperlipidämie
- COPD

Abbildung: Risikofaktoren für die Entwicklung großer AAA über 4 cm nach einer großen Kohortenstudie (US Veterans Affair Study). Rauchen stellt mit großem Abstand den größten Risikofaktor dar.
KLINISCHE BESCHWERDEN DES BAUCHAORTENANEURYSMAS
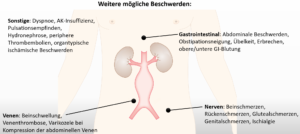
Oft bleibt das AAA aufgrund der häufigen Beschwerdefreiheit oder nur unspezifischen Beschwerden bis zur Ruptur oder bis zum Auftreten von Komplikationen (z.B. Thrombembolie in ein Beingefäß) unerkannt. Nicht selten wird das AAA zufällig im Rahmen von Screeninguntersuchungen oder bei Bildgebungen der Bauchorgane (z.B. Röntgen-Abdomen, CT der Bauchorgane) erkannt. Die meisten vom wachsenden Aortenaneurysma verursachten Beschwerden lassen sich dabei auf die Kompression umliegender Organe zurückführen. So kann z.B. eine Kompression der abdominellen Venen zu einer Beinschwellung, Venenthrombose oder Varikozele führen. Eine Harnstauung oder Obstipationsneigung kann auf eine Verdrängung des Ureters oder der Darmorgane zurückzuführen sein. Wenige Beschwerden, wie z.B. Schmerzen direkt über dem Aneurysma, eine plötzliche Kreislaufeinschränkung oder gastrointestinale Blutungen, zeigen eine besondere Gefahr oder die bereits stattgehabte Ruptur an. In etwa 25 bis 50 % der Fälle zeigt sich die stattgehabte Ruptur durch das Symptomtrias aus Rücken- oder Abdominalschmerzen, Hypotension und einer pulsatilen abdominellen Raumforderung. Die Ruptur eines Bauchaortenaneurysmas kann dabei retroperitoneal, frei in die Bauchhöhle oder in angeschlossene Hohlorgane erfolgen. Von einer sogenannten „gedeckten“ Ruptur spricht man, wenn sich die Aortenruptur in das Retroperitoneum nach einer Initialphase zunächst selbst tamponiert.
- Abdominale Beschwerden
- Obstipationsneigung
- Übelkeit und Erbrechen
- obere/untere GI-Blutung
- Beinschmerzen
- Rückenschmerzen
- Glutäalschmerzen
- Genitalschmerzen
- Beinschwellung
- Venenthrombose
- Varikozele
- Dyspnoe
- Pulsationsempfinden
- Hydronephrose
- periphere Thrombembolie
Die stattgehabte Ruptur äußert sich bei 25 – 50 % der Patienten durch das Symptomtrias aus: Rücken- oder Abdominalschmerzen, Hypotonie, pulsatile abdominale Raumforderung.
DIAGNOSTIK DES BAUCHAORTENANEURYSMAS
Die klinische Untersuchung spielt, insbesondere bei kleineren Befunden, aufgrund der eingeschränkten Sensitivität und Spezifität nur eine untergeordnete Rolle. In der Stufendiagnostik des AAA spielt zunächst die farbkodierte Duplexsonographie („Duplexsonographie“) eine wichtige Rolle. Abhängig von der Erfahrung des Untersuchers können Größenausmaße, Thrombosierungen und Lagebeziehungen zu den Nierenarterien mit einer hohen Treffsicherheit ermittelt werden. Goldstandard in der Therapieplanung, insbesondere vor einer endovaskulären Versorgung, ist weiterhin die Spiral-CTA (computertomographische Angiographie). Durch hochauflösende Geräte und computergestützte Auswertungen lassen sich mittlerweile hochgenaue 3-D-Rekonstruktionen erstellen, anhand derer die exakte Therapieplanung erfolgen kann. Mit der Kontrastmittel-Magnetresonanztomographie (MRA) lassen sich heute auch ohne Strahlenbelastung hochgenaue Gefäßdarstellungen anfertigen. Die niedrigere Auflösung der MRA und die unzureichende Beurteilbarkeit von Verkalkungen machen aber weiterhin die Spiral-CTA zum primären Verfahren.

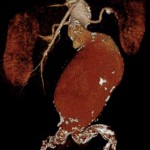
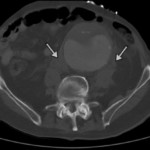
Abbildung: Verschiedene Bildgebungen von Bauchaortenaneurysmen (AAA). Links oben: Sonographie mit Wandthrombosierung (Pfeil). Links mitte: Sonographie mit einliegendem Stentgraft (Pfeil). Links unten: Aortenruptur eines großen AAA mit retroperitonealer Blutfahne (Pfeil). Mitte oben: 3-D-Rekonstruktion eines infrarenalen AAA (Pfeil). Mitte unten: Wandverkalkte Aorta und Iliakalgefäße. Wandthrombosierung des AAA (Pfeil). Rechts oben: MRA eines kleinen sakkulären AAA (Pfeil). Rechts unten: Digitale Subtraktionsangiographie in einer endovaskulären Prozedur vor Auslösung des Stentgrafts unterhalb der Nierenarterienabgänge.
Farbkodierte Duplexsonographie
Die farbkodierte Duplexsonographie (CDUS, FKDS) spielt insbesondere in der Erstuntersuchung der abdominellen Aorta oder bei Screeninguntersuchungen eine herausragende Rolle. Die Sensitivität und Spezifität dieser Untersuchung kann mit modernen Geräten und geübten Untersuchern bis zu 100 % betragen. Durch eine Kontrastmittelverstärkung (Mikrobläschen) können auch Undichtigkeiten von Stentprothesen nachgewiesen werden.
Die standardisierte Untersuchung des AAA sollte in der B-Bild-Sonographie („Graubild“) mit dem konvexen Abdomenschallkopf streng orthogonal an der Stelle des maximalen Querdurchmessers erfolgen und eine Messung in anteriorposteriorer und transversaler Richtung beinhalten. Die Lagebeziehung zu den Nierenarterienabgängen (infrarenal vs. juxtarenal vs. suprarenal) sollte ebenso dokumentiert werden, wie die zeitliche Beziehung zum kardialen Auswurfzyklus (systolisch vs. diastolisch) und eine mögliche Thrombosierung.
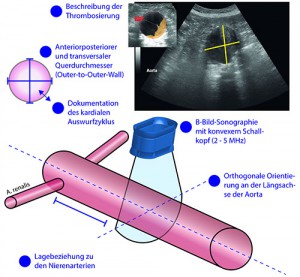
Abbildung: Schematische Darstellung einer einfachen Screening-Untersuchung auf abdominelle Aortenaneurysmen mittels farbkodierter Duplexsonographie.
- Sensitivität: 94 – 100 %. Spezifität: 98 – 100 %
- Vorteile: Günstiges Verfahren, keine Strahlenbelastung, hohe Auflösung, für Interventionen geeignet, neue Verfahren (Kontrastmittelverstärkung, 3-D-CEUS)
- Nachteile und Gefahren: Untersucherabhängigkeit, geringe Gewebeerwärmung
Spiralcomputertomographie mit Kontrastmittel
Goldstandard in der präoperativen Therapieplanung und zur postinterventionellen Verlaufskontrolle nach EVAR ist seit vielen Jahren die kontrastmittelgestützte Spiral-Computertomografie (SCTA). Seit der Würdigung der beiden Erfinder A. M. Cormack und G. N. Hounsfield durch den Nobelpreis für Medizin im Jahre 1979 wurde diese röntgendiagnostische Bildgebung durch zahlreiche Weiterentwicklungen zu einem unersetzbaren diagnostischen Verfahren in der Gefäßmedizin. Durch Verbesserungen der Bildqualität und Aufnahmezeit können heute immer höhere Auflösungen bei geringerer Strahlenexposition erreicht werden. Die kalkulierte Strahlendosis einer modernen SCTA in drei Phasen beträgt heute noch etwa 27,4 mSv
Risikofaktoren für das Auftreten einer kontrastmittelassoziierten Nephropathie (CIN) [33]:
- Lebensalter über 65 Jahre
- GFR < 45 ml/min
- Diabetes mellitus
Zur Vermeidung einer anaphylaktischen Reaktion auf Kontrastmittel kann bei Vorliegen einer gesicherten Kontrastmittelallergie die vorbereitende intravenöse Gabe eines H1-Antihistaminikums (z.B. Clemastin), eines H2-Antihistaminikums (z.B. Ranitidin) und Prednisolon über 3 Tage sowie die Stoßtherapie mit Prednisolon am Tag der KM-Gabe evaluiert werden. Letztlich kann das Kontrastmittel auch zu einer potentiell lebensbedrohlichen jodinduzierten Hyperthyreose führen, weshalb bei Risikopatienten eine medikamentöse thyreostatische Therapie mit 900 mg Natriumperchlorat pro Tag sowie gegebenenfalls 10 – 20 mg Thiamazol pro Tag vor der KM-Gabe über 10 bis 14 Tage unter Verlaufskontrolle der Schilddrüsenparameter empfohlen wird. Die moderne SCTA hat eine Sensitivität von 93 – 100 % und eine Spezifität von bis zu 96 %.
- Sensitivität: 93 – 100 %. Spezifität: bis zu 96 %
- Vorteile: Hohe Auflösung, gute Verfügbarkeit, Möglichkeit der 3-D-CTA
- Nachteileund Gefahren: Strahlenexposition, Kontrastmittelallergien, kontrastmittelassoziierte Nephropathie, jodinduzierte Hyperthyreose
Magnetresonanztomographie mit Kontrastmittel
Mit einer Sensitivität von 96 % und einer Spezifität von bis zu 100 % gilt die kontrastmittelgestützte Magnetresonanztomografie (MRTA) heute für viele Indikationen als Alternative zur SCTA ohne die damit verbundene Strahlenbelastung [34]. Aufgrund der geringeren Bildauflösung der MRTA gilt die SCTA jedoch weiterhin als Standardverfahren bei der Planung von EVAR-Eingriffen. Bei der MRTA werden starke Magnetfelder oder Radiowellen eingesetzt, um aus den daraus resultierenden Kernresonanzen verschiedener Elemente ein Bild zu errechnen. Durch Anwendung meist extrazellulärer Kontrastmittel (z.B. Gadolinium-haltige KM) kann ein höherer Kontrast und damit eine bessere Darstellung der Gefäße erreicht werden (Abb. 9). Grenzen hat die MRTA vor allem bei ferromagnetischen oder elektromagnetisch störanfälligen Implantaten im Körper des Patienten (z.B. ICD-Schrittmacher), Allergien gegen Gadolinium-haltige Kontrastmittel und bei Vorliegen einer relevanten Niereninsuffizienz. Bei vorbestehend schwerer Einschränkung der Nierenfunktion kann es nach Gadolinium-Gabe sehr selten zu einer potentiell tödlichen nephrogenen systemischen Fibrose (NSF) kommen, die sich durch krankhafte Bindegewebsvermehrung in Haut und inneren Organen äußert [35]. Aufgrund der Bauform und starken Geräuschkulisse vieler MRTA ist diese Diagnostik außerdem bei Patienten mit Klaustrophobie nicht ohne weiteres anzuwenden. Modernere Geräte mit einer offenen oder sogar stehenden Bauform (sog. Upright-Geräte) können hier eine Alternative darstellen.
- Sensitivität: 96 %. Spezifität: bis zu 100%
- Vorteile: keine Strahlenbelastung, kein jodhaltiges KM
- Nachteileund Gefahren: Hohe Kosten und geringe Verfügbarkeit, etwas geringere Bildauflösung als die SCTA, Untersuchungsdauer, Kontrastmittelallergien, nephrogene systemische Fibrose (NSF), Geräuschbelastung
Screening auf Bauchaortenaneurysmen
Zahlreiche internationale Diskussionen und Ergebnisse verschiedener randomisierter kontrollierter Studien haben in den letzten Jahren dazu geführt, dass in England, den USA und in Schweden bereits Screeningprogramme zur Früherkennung des AAA etabliert wurden. In Deutschland steht eine Entscheidung über die Einführung eines Ultraschallscreenings derweil noch aus. In einer vorläufigen Nutzenbewertung des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) wurde auf den Nutzen eines Ultraschallscreenings auf AAA für ältere Männer hingewiesen, während sich bisher keine Evidenz für einen Nutzen des Screenings für Frauen ergab.
Empfehlungen der europäischen Fachgesellschaften zur Verlaufskontrolle kleiner AAA:
- Querdurchmesser 3,0 bis 3,9 cm: Ultraschallkontrolle in 24 Monaten
- Querdurchmesser 4,0 bis 4,5 cm: Ultraschallkontrolle in 12 Monaten
- Querdurchmesser 4,6 bis 5,0 cm: Ultraschallkontrolle in 6 Monaten
- Querdurchmesser über 5,0 cm: Ultraschallkontrolle in 3 Monaten
THERAPIE DES ABDOMINELLEN AORTENANEURYSMAS
Ab einer Größe von 5 (veraltete Empfehlungen) bis 5,5 cm (bei Frauen ab 5,2 cm) ist das Rupturrisiko im Spontanverlauf in der Regel größer, als das OP-Risiko, weshalb die Indikation zur invasiven Aneurysmaausschaltung besteht. Neben der Größe gilt eine rasche Größenzunahme über 5 mm in 6 Monaten, eine Beschwerdesymptomatik (z.B. Druckschmerz über dem Aneurysmasack) und die thrombembolische Komplikation als OP-Indikation. Das rupturierte Aortenaneurysma gilt als Notfallindikation.
OP-Indikationen:
- Größendurchmesser über 5,5 cm (alt: 5 cm) bei Männern und 5,2 cm bei Frauen
- Rasche Größenzunahme über 5 mm in 6 Monaten
- Auf das Aneurysma zurückzuführende Symptomatik
- Thrombembolische Komplikation (z.B. nach peripher verschleppte Embolie)
- Aneurysmaruptur
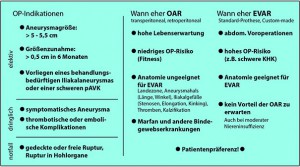
Abbildung: OP-Indikationen und Entscheidungshilfen für die beiden konkurrierenden invasiven Therapieverfahren.
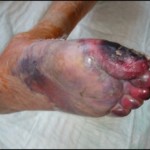
Abbildung: Klinischer Nachweis von embolisch bedingten trockenen und feuchten Nekrosen des linken Vorfußes auf dem Boden von Embolien eines Aneurysmas (sog. „Trash foot Syndrom“).
Für die invasive Therapie des AAA stehen grundsätzlich zwei Verfahren zur Verfügung:
Die offen-chirurgische Aneurysmaausschaltung (OAR: open aortic repair) und die endovaskuläre Aneurysmaausschaltung (EVAR: endovaskular aortic repair).
Für die OAR sprechen eine hohe Lebenserwartung, ein niedriges OP-Risiko bei guter Fitness des Patienten, eine für die endovaskuläre Versorgung ungeeignete Anatomie oder das Vorliegen von Bindegewebserkrankungen (z.B. Marfan-Syndrom). EVAR kann Vorteile bringen bei abdominellen Voroperationen (Verwachsungsbauch), einem hohen OP-Risiko bei niedriger Fitness und bei Vorliegen einer gut geeigneten Anatomie. Selbstverständlich spielt auch die Patientenprävalenz eine bedeutende Rolle. Im Kurzzeitverlauf hat sich die EVAR durch eine signifikant niedrigere Letalität im Vergleich zur OAR ausgezeichnet, wobei sich dieser Vorteil nach etwa 2 bis 3 Jahren wieder aufhebt. Trotzdem zählt EVAR im Gegensatz zu OAR heute nicht mehr zu den Hochrisikoeingriffen. Trotz des allgemeinen Trends zu EVAR stellen AAA mit komplizierter Anatomie und starker Verkalkung der Zugangsgefäße sowie Patienten mit Kontrastmittelkontraindikationen eine wichtige Indikationsgruppe der OAR dar. Darüber hinaus sind nach EVAR lebenslange bildgebende Verlaufskontrollen erforderlich, wobei dies aktuell meist noch durch strahlenbelastende CT-Angiographien realisiert wird.
OFFEN-CHIRURGISCHE ANEURYSMAAUSSCHALTUNG (OAR)
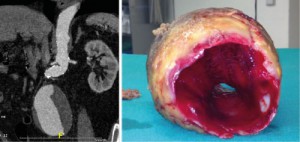
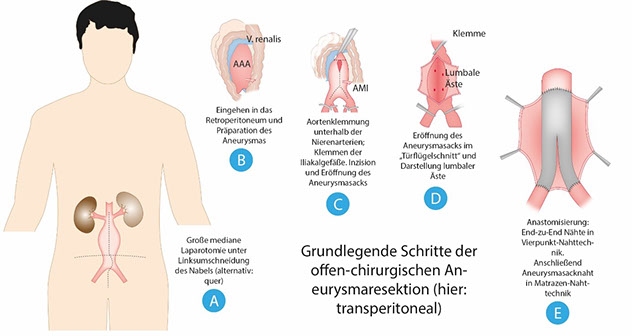
Bei der offen-chirurgischen Aneurysmaresektion wird über einen transperitonealen Zugang (Längs- oder quere Laparotomie) oder über einen retroperitonealen Zugang von links das Retroperitoneum und das darin liegende Aneurysma freigelegt. Nach dem Ausklemmen des betroffenen Gefäßabschnitts wird das Aneurysma eröffnet und eventuell vorhandenes Thrombusmaterial entfernt. Für den Gefäßersatz stehen Rohrprothesen oder aorto-bi-iliakale „Y-Prothesen“ aus PTFE („Teflon“) oder Polyester („Dacron“) zur Verfügung, die proximal und distal End-zu-End anastomisiert werden (Abbildung 7).
ENDOVASKULÄRE ANEURYSMAAUSSCHALTUNG (EVAR)
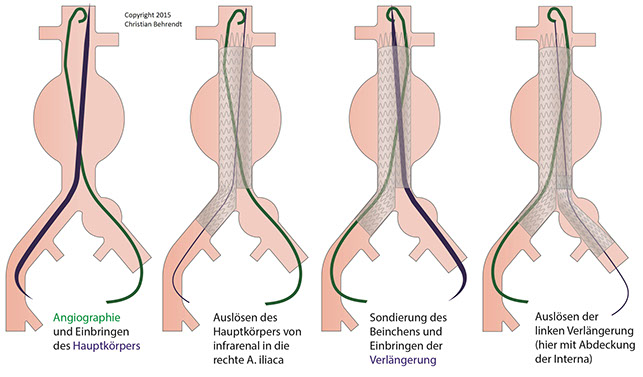
Die endovaskuläre Aneurysmaauschaltung mit Stentgrafts wurde bereits in den 1980er Jahren durch den ukrainischen Chirurgen Nikolay L. Volodos beschrieben. Heute steht eine große Zahl an Stent-Prothesen verschiedener Hersteller für die Ausschaltung einfacher und komplexer AAA zur Verfügung. Die endovaskuläre Aneurysmaausschaltung besteht in einer Punktion der gewählten Zugangsgefäße (in der Regel: A. femoralis communis), dem Einbringen einer ausreichend dimensionierten Schleuse und der Darstellung des Aneurysmas mittels kontrastmittelgestützter digitaler Subtraktionsangiographie (DSA). Nach der Angiographie erfolgt die Positionierung des Prothesenkörpers. Dabei muss das proximale Ende des Stentgrafts ausreichend in der sogenannten proximalen „Landezone“ verankert werden, ohne die Nierenarterienabgänge zu verschließen und damit einen Niereninfarkt zu verursachen. In der Regel werden aorto-bi-iliakale Stentprothesen verwendet, die in die Iliakalgefäße hineinreichen. Sofern das proximale und die distalen Landezonen ausreichend durch die Prothese abgedichtet werden, ist das Aneurysma vom Blutkreislauf abgeschnitten und damit ausgeschaltet. In bis zu 20 % der Fälle kommt es zu sogenannten Endoleckagen, d.h. Undichtigkeiten mit andauernder Perfusion des Aneurysmasacks. Je nach Art der Leckage werden dann weitere Maßnahmen erforderlich.

Abbildung: Klassifikation der sog. Endoleckagen (Undichtigkeiten) nach endovaskulärer Aneurysmaausschaltung. Von besonderer Bedeutung sind die Typen Ia (proximal) und Ib (distal) aufgrund des hohen persistierenden Drucks im Aneurysmasack und der erhöhten Rupturgefahr.